1
Cancro do endométrio
Epidemiologia
O cancro do endométrio (CE) é um tumor epitelial maligno que se origina no epitélio glandular da mucosa endometrial. Constitui, por todo o mundo, cerca de metade de todos os tumores malignos de aparelho genital feminino. Nos últimos tempos tem havido um aumento da sua incidência nos países industrializados. Nos EUA ocupa o primeiro lugar entre os cancros ginecológicos. Em Portugal é o sexto tumor maligno mais frequente na mulher portuguesa, constituindo uma preocupação para os Serviços de Saúde. Segundo a ROR Centro, a taxa de incidência padronizada deste tumor é de 12/100.000. É extremamente raro abaixo dos 35 anos. A idade média das mulheres atingidas situa-se na década dos 60 anos. A partir dos 48 anos torna-se mais frequente do que o carcinoma do colo uterino. Não raras vezes a mulher está assintomática, outras vezes refere um corrimento irregular sero-hemático, intermenstrual, indolor. O sintoma cardinal é a metrorragia. A perda vaginal de aspecto aquoso ou purulento, assim como a dor pélvica, podem aparecer, mas são menos frequentes. A maior parte dos doentes apresenta-se em estádio I (Quadro
I). Esta classificação trouxe uma melhor definição do risco ao permitir valorizar os factores de prognóstico:
uterinos (tipo histológico, grau de diferenciação, penetração miometrial, extensão ao colo, invasão vascular e linfática),
extra-uterinos (citologia peritoneal positiva, metástases nos anexos, metástases ganglionares loco-regionais, disseminação macroscópica na serosa uterina),
outros (idade, receptores de esteróides?). O adenocarcinoma é o tipo histológico mais comum. O adenocarcinoma endometrióide representa 80% de todos os CE; o adenocarcinoma papilar seroso e o de células claras são os de pior prognóstico. Menos de 2% de todos os tumores do endométrio envolvem proliferação do estroma do endométrio (sarcoma, adenosarcoma e carcinosarcoma). Podem distinguir-se dois grupos de doentes que apresentam histórias naturais diferentes.
10
Quadro I
|
Cancro do endométrio - Estadiamento Cirúrgico |
| Estadio I a |
grau 1; 2; 3 |
Tumor limitado ao endométrio |
|
Estadio I b |
grau 1; 2; 3 |
Invasão de menos de metade do miométrio |
|
Estadio I c |
grau 1; 2; 3 |
Invasão de mais de metade do miométrio |
|
Estadio II a |
grau 1; 2; 3 |
Envolvimento das glândulas endocervicais |
|
Estadio II b |
grau 1; 2; 3 |
Invasão do estroma cervical |
|
Estadio III a |
grau 1; 2; 3 |
Invasão serosa e/ou anexos e/ou citologia peritoneal positiva |
| Estadio III
b |
grau 1; 2; 3 |
Metástase vaginal |
|
Estadio III c |
grau 1; 2; 3 |
Metástase pélvica e/ou invasão gânglios para-aórticos |
| Estadio IV
a |
grau 1; 2; 3 |
Tumor invade bexiga e/ou mucosa rectal |
|
Estadio IV b |
grau 1; 2; 3 |
Metástase à distância/nódulo positivo intra-abdominal e/ou inguinal |
Fonte: International Federation of Gynecology and Obstetrics (FIGO - 1988)
Grau 1: tumor bem diferenciado; corresponde a 5% ou menos de um padrão de crescimento sólido não escamoso;
Grau 2: Tumor moderadamente diferenciado; corresponde de 6% a 50% do mesmo padrão.
Grau 3: tumor pouco diferenciado ou indiferenciado; corresponde a mais de 50% do mesmo padrão.
No primeiro grupo estão incluídas mulheres na perimenopausa, obesas, frequentemente diabéticas, nulíparas e com história de anovulação ou de infertilidade. Por vezes registam-se antecedentes de hiperplasia endometrial, possivelmente relacionada com estimulação estrogénica mantida, fazendo deduzir a existência de um lento desenvolvimento evolutivo para a malignidade. Estes tumores constituem 65% dos cancros endometriais. Usualmente são detectados em estádios mais precoces; histologicamente predominam os tipos de baixo grau, com maior diferenciação (adenoacantoma – uma variante do adenocarcinoma que contem metaplasia escamosa benigna – adenocarcinoma endometrióide bem diferenciado) e os receptores hormonais esteróides respondem positivamente. No segundo grupo, o tumor aparece já na pós-menopausa, em multíparas, sem excessiva massa corporal, sem evidência prévia de hiperplasia e sem aparente relação com estimulação estrogénica e para o qual não se adivinham factores predisponentes. O tipo histológico é menos diferenciado e de grau mais avançado. Usualmente os receptores esteróides são negativos, a invasão miometrial mais profunda e a sua evolução é muito mais agressiva.
2
Factores de
risco
A identificação dos factores de risco é importante para sinalizar qual a população que poderá beneficiar de uma maior vigilância para evitar esta doença. É fácil entender porque alguns factores de risco englobam todas as situações que conduzem a um hipoestrogenismo não contrabalançado com a progesterona natural ou sintética. Tumor produtor de estrogénios; sindroma dos ovários poliquísticos/anovulação crónica; obesidade; menarca precoce/menopausa tardia; infertilidade/nuliparidade; diabetes/patologia da tiróide/patologia da vesícula biliar; mulheres pós-menopáusicas medicadas com terapêutica estrogénica substitutiva. Outros factores de risco com expressividade relativa são: raça branca; níveis elevados de educação; residentes do Norte da América e da Europa.
3
Prevenção
primária
O uso de contraceptivos orais (CO) combinados, protegem contra o CE, mesmo na mulher nulípara. Segundo um estudo multicêntrico orientado pelo Cancer and Stevid Hormone Study of the Centers for Disease Control os CO protegem contra os três tipos histológicos mais comuns do CE. Essa protecção começa no primeiro ano de uso, persiste pelo menos 15 anos após a sua descontinuação e o tempo de utilização tem um efeito cumulativo protector. A mesma redução no risco do CE, foi encontrada no estudo conjunto do Walnut Creek Contraceptive Drug Study do nordeste da Califórnia e do Royal College of General Practitioner’s Oral Contraception Study do Reino Unido (em 47.000 mulheres houve uma redução de 80% com RR de 0,2). Nestes estudos determinou-se que essa protecção estava associada a todos os fármacos contraceptivos combinados. Contudo, outro artigo de âmbito internacional tipo caso/controlo mostrou que a protecção estava ligada aos contraceptivos com baixa dose de estrogénios e alta dose de progestagénios. A protecção adquirida pelos métodos contraceptivos orais tem de ser ponderada de acordo com os riscos já conhecidos – doença cardiovascular, cancro hepático e cancro mamário em alguns casos. Contudo os utilizadores dos CO têm menores índices de mortalidade e de complicações que necessitem de internamento hospitalar do que as mulheres sexualmente activas que não utilizam os anovulatórios. Os CO combinados com o seu efeito protector parecem ser uma das razões da diminuição da incidência do CE de acordo com dados recentes da literatura científica. A utilização do
acetato de medroxiprogesterona «depot» para a contracepção também exerce uma acção protectora neste tipo de cancro. Num estudo tailandês o risco relativo do CE em utilizadoras deste produto foi de 0,2. Uma correlação altamente significativa foi encontrada entre o peso corporal e o risco de cancro. Mas o que tem importância é a quantidade total de adiposidade e não a sua distribuição. Há necessidade de
evitar e/ou vigiar todas as situações com estimulação estrogénica exógena sem o contraponto de progestagénio (o tamoxifeno na terapêutica adicional do cancro da mama pelo seu efeito agonista nos receptores endometriais; a adição de progesterona ao estrogénio na terapêutica hormonal de substituição na menopausa diminui significativamente o risco de CE na mulher em falência ovárica).
Deve-se: detectar e tratar todos os casos de anovulação crónica com amenorreia prolongada (infertilidade com disovulação, situação de síndroma dos ovários poliquísticos);
detectar e equilibrar os distúrbios metabólicos associados ao risco relativo de CE (diabetes, doença da tiróide);
evitar a obesidade, minimizando o risco da anovulação e da situação de hiperestrogenismo endógeno devido à conversão, no tecido adiposo periférico, da androstenediona em estrona. Estratégias em prevenção primária estão a ser praticadas por muitas equipas de saúde, principalmente a nível dos Cuidados Primários.
4
Diagnóstico
Perante uma hemorragia uterina anormal um teste de gravidez pode ser realizado numa doente em idade reprodutiva. Mas o CE deve ser considerado nestas mulheres especialmente naquelas com um ou mais factores de risco, já que 10% dos CE ocorrem em mulheres com menos de 45 anos. Na mulher perimenopáusica pode ser difícil determinar uma hemorragia uterina anormal devido às alterações do ciclo menstrual. A prática da Clínica geral nos EU determina que qualquer mulher com mais de 40 anos e com hemorragia vaginal anormal requer avaliação do endométrio. Em Inglaterra a orientação hospitalar tende a seguir os mesmos passos. A história e os factores de risco devem ser cuidadosamente avaliados tanto nestas mulheres como nas pós-menopáusicas. Qualquer hemorragia no período pós-menopáusico deve ser considerado anormal, tanto mais que 7% correspondem a doença maligna. À mulher com perfil de risco ou com clínica suspeita inicia-se o estudo com o pedido de uma ecografia pélvica e transvaginal. Será valorizado o espessamento da linha endometrial (ecocomplexo endometrial), a sua heterogeneidade, a sua relação com a interface miometrial, e são avaliadas as áreas anexiais (índice morfológico de Priest e Col) e o fundo de saco de Douglas (líquido ascítico?). Na literatura mundial tem sido proposto às mulheres pós-menopáusicas, assintomáticas mas com perfil de risco a realização de um rastreio ecográfico com sonda endovaginal, para seleccionar os casos cuja espessura endometrial seja igual ou superior a 5 mm. Nesta situação são enviadas aos cuidados secundários para a execução de um estudo histológico. No Canadá não é recomendado o uso de rastreio do carcinoma do endométrio em mulheres assintomáticas, porque não há evidência sobre a sua eficácia clínica. Para a detecção precoce do cancro do endométrio o Serviço de Ginecologia do Hospital Dr. José Maria Grande adoptou uma modificação do protocolo do Instituto Dexeus (Quadro
I). Tal protocolo foi testado previamente à sua implementação através de estudo histeroscópico com biopsia dirigida, de todas as mulheres pós-menopáusicas ou com clínica suspeita ou assintomáticas mas com perfil de risco, no período de 1991 a 1996. Foi a concordância entre os resultados da biopsia e do exame ecográfico endovaginal que validaram a adopção do protocolo: ecocomplexo > 5 mm obriga a avaliação do endométrio. O diagnóstico de certeza é histológico; através do estudo anatomo-patológico de fragmentos endometriais, colhidos em biopsia direccionada pela visão histeroscópica ou às cegas, por intermédio da curetagem uterina (dilatação e curetagem) total e fraccionada, sob anestesia geral. A biopsia do endométrio por aspiração remove uma pequena quantidade, e não necessita anestesia. É praticada nos EU pelos Clínicos Gerais, e é recomendada como o primeiro exame complementar de diagnóstico em todos os casos de hemorragia pós-menopáusica. Uma segunda hemorragia exigirá referenciação aos Cuidados Secundários. Após o resultado histológico, positivo para a malignidade, e de acordo com o seu grau de agressividade, completa-se o estadiamento com a tomografia axial computorizada ou a ressonância magnética. Estes exames permitem o esclarecimento do grau de invasão do miométrio, do istmo e do canal endocervical, da existência de disseminação linfática (gânglios pélvicos ou lombo-aórticos) ou vascular, em órgãos mais distantes, extra-genitais. O marcador tumoral CA 125 é pedido para avaliação pré-operatória da eventual localização extra-uterina e para comparação futura em termos de eficácia terapêutica e do prognóstico. Este estadiamento clínico globalizante vai permitir um conhecimento correcto do caso e uma eficaz orientação terapêutica.
11
Quadro II

5
Neoplasias do ovário
Epidemiologia e factores de risco
O cancro do ovário (COv) é uma doença altamente letal e responsável por mais mortes do que todos os outros cancros ginecológicos combinados. Dentro destes é o segundo mais frequente na maioria dos países desenvolvidos. Nos Estados Unidos da América é a quarta causa de morte mais comum entre as mulheres. Em 1996, foram descobertos 24.000 novos casos de COv e destes 14.500 faleceram da doença primária. A prevalência é de 30 a 50 por 100.000 mulheres. Segundo a maioria dos autores a taxa de 5 anos de sobrevivência não ultrapassa os 35% para o cancro detectado em estádio II e 10 a 15% nos estádios III e IV. Para o cancro localizado aos ovários essa taxa varia entre os 66% e os 90%, mas só 25% das mulheres têm um diagnóstico no estádio I.
Este mau prognóstico resulta de um diagnóstico tardio por ausência de sinais de aviso e ineficiência de técnicas para a detecção precoce, dos tipos histológicos agressivos, de uma resistência aos métodos habituais de tratamento e à falta de treino cirúrgico (oncológico e multidisciplinar) para um correcto estadiamento desta doença.
A neoplasia do ovário pode ser dividida em 3 grupos consoante a sua origem histogenética: neoplasias derivadas do epitélio de superfície, neoplasias derivadas do estroma e neoplasias derivadas das células germinativas. A primeira categoria corresponde a 85% de todos os cancros do ovário.
Não há uma identificação completa dos factores de risco tal como estão para o cancro cervical (actividade sexual precoce, promiscuidade sexual, multiparidade, doenças sexualmente transmissíveis) e para o cancro endometrial (obesidade, menopausa tardia, infertilidade, disfunção ovárica crónica). A
idade é um factor de risco sendo mais comum na mulher a partir dos 60 anos. Aceita-se a hipótese de que a ovulação repetitiva e incessante durante a vida reprodutiva possa estar relacionada com a neoplasia, e vem explicar a razão da
nuliparidade ou do 1º parto tardio (+ 35 anos) como factores de risco. Os outros são uma
história pessoal de cancro do endométrio, cólon ou mama mas o mais importante é a existência de uma
história familiar de COv (370/100.000) nomeadamente o Síndroma Hereditário do cancro do ovário, do cancro da mama e ovário e o Síndroma de Lynch II. Conhecem-se os genes responsáveis por estas situações, mas não têm sido utilizados como testes de rastreio na população em geral (BRCA1 e BRCA2)
6
Clínica
O COv tem um início insidioso, usualmente assintomático sendo os primeiros sinais e sintomas muito vagos e relacionados com a disseminação para outros órgãos intra-abdominais: aumento de volume abdominal por ascite, dor surda no hipogástrio, astenia, perda de peso, dor aguda por compressão ureteral, sintomatologia digestiva. Por altura do diagnóstico mais de 2/3 dos doentes têm a doença disseminada (quadro
III).
Tem havido um interesse crescente no desenvolvimento de métodos que possam detectar, na mulher assintomática, cancros ováricos «curáveis».
7
Rastreio
O cancro do ovário preenche os pré-requisitos da doença que pode beneficiar de um rastreio.
Para que qualquer rastreio seja efectivo, vários critérios têm de se cruzar:
1. A doença deve ter consequência fatídica.
2. O tratamento tem de ser mais efectivo na doença detectada pelo rastreio do que na detectada pelos sintomas.
É necessário que o cancro em estádio I possa ser identificado pelo rastreio, em oposição aos cancros detectados pelo sintoma em estádio III. Contudo, ainda não há dados que permitam dizer se um estádio I detectado pelo rastreio tem um prognóstico diferente do detectado pelo sintoma em estádio I.
3. O terceiro critério tem a ver com uma alta prevalência da doença detectável em fase pré-clínica.
Aqui surgem alguns problemas pois o COv não é duma doença facilmente rastreável, tanto devido à baixa prevalência da doença na população geral como à pequena percentagem de mulheres (1%) com uma história familiar de Síndroma de cancro hereditário.
Caracterizam-se por aparecerem em idades mais precoces e pela ocorrência em múltiplos membros de uma família por 2 a 4 gerações. A probabilidade de um membro dessa família adquirir o COv pode chegar a 50%. São estas as candidatas de 1ª linha para um rastreio do COv.
Em 2ª linha vêm as mulheres pós-menopáusicas, as inférteis e as nuligestas.
12
Quadro III
|
Cancro do ovário – Estadiamento Cirúrgico |
|
I Crescimento limitado aos ovários |
A. Um
ovário
B. Ambos os ovários
C. Tumor à superfície do ovário e/ou cápsula aberta e/ou ascite maligna ou citologia peritoneal
positiva |
| II Extensão
pélvica |
A. Tumor estendendo-se ao útero ou trompas
B. Tumor estendendo-se a outros tecidos pélvicos
C. Tumor como A ou B mas na cápsula e/ou ascite maligna ou citologia peritoneal
positiva |
| III Tumor com implantes peritoneais fora da pélvis e/ou gânglios linfáticos inguinais ou retroperitoneais
positivos. |
A. Tumor limitado à pélvis com gânglios linfáticos negativos mas disseminação microscópica para a superfície
peritoneal
B. Tumor peritoneal menor ou igual a 2 cm de diâmetro com gânglios linfáticos
negativos
C. Tumor peritoneal maior do que 2 cm e/ou gânglios linfáticos
positivos |
| IV Disseminação à distância (fora da cavidade peritoneal) |
Fonte: International Federation of Gynecology and Obstetrics (F I G O)
8
Testes de rastreio para a Neoplasia Maligna do Ovário
Um teste óptimo terá de ser seguro, fácil de executar, fornecer resultado em tempo óptimo e ser bem aceite pelo doente.
O United States Preventive Services Task Force e o Canadian Task Force on the Periodic Health Examination estabeleceram critérios para testes de rastreio que levem à detecção da doença em indivíduos assintomáticos. Para além das características apontadas o teste deve ser suficientemente sensível e específico a fim de que apareçam poucos resultados falso-negativos ou falso-positivos levando a valores preditivos positivo e negativo altos. Resultados falso-positivos levam a estudos de «follow-up» dispendiosos e desnecessários e causam ansiedade; resultados falso-negativos podem oferecer falsa confiança.
Devido à baixa prevalência da doença e para um determinado valor de sensibilidade e especificidade ainda não há testes de rastreio que forneçam um valor preditivo positivo confortável. Um teste de rastreio para ser considerado efectivo deve produzir:
1. a diminuição do estádio ao tempo do diagnóstico;
2. a diminuição da mortalidade do cancro detectado;
3. a redução da mortalidade na população rastreada versus população não rastreada.
Os quatro testes de rastreio utilizados são: Exame pélvico, CA 125, Ecografia transvaginal e Fluxometria doppler transvaginal a cores.
Exame pélvico
A falta de sensibilidade deste método resulta na identificação de cancros em estádios avançados. Este exame é ineficaz para detectar o cancro do ovário em estádio I. Contudo um exame pélvico anual, com cuidadosa palpação de ambos os ovários continua sendo um componente essencial do diagnóstico do cancro do ovário.
CA 125
O CA 125 é um determinante antigénico que corresponde a uma glicoproteína com alto peso molecular, reconhecida pelo anticorpo monoclonal OC 125. É a expressão de neoplasia epitelial ovárica não mucinosa, e está presente em altas concentrações na superfície das células tumorais. Os níveis séricos de CA 125 (N
<= 35 U/ml)estão elevados em cerca de 80% dos doentes com cancro do ovário. Contudo níveis anormais só aparecem em 25% dos doentes em estádio I detectado clinicamente.
A sensibilidade e a especificidade do CA 125 são de 82% e 67% respectivamente, para o nível sérico apontado. Os falso-positivos referem-se a situações benignas (endometriose, doença inflamatória pélvica, fibrose uterina, gravidez, cirrose hepática) e malignos (tumores do fígado, pulmão, mama, cólon, pâncreas, endométrio, colo uterino). A falta de sensibilidade do CA 125 para detectar estádios precoces, tem sido uma das limitações no seu uso como método de rastreio.
Ecografia transvaginal/Fluxometria «Doppler»
É o método mais eficaz para o rastreio do COv. Esta ecografia é efectuada com um ecógrafo standard, com uma sonda vaginal de 5/7,5 mHz.
O teste é indolor, efectuado com a bexiga vazia. O volume do ovário é calculado por uma fórmula (L x A x C x 0,523).
Um volume ovárico >= 20cm3 na mulher pré-menopaúsica e >= 10 cm3 na pós-menopaúsica é anormal. Qualquer projecção papilar da parede interna do ovário é anormal.
Devido à moderada especificidade e baixos valores preditivos positivo e negativo associam-se aos marcadores tumorais a análise da morfologia tumoral e a fluxometria «doppler». De Priest et al elaboraram um índice morfológico (IM) para o cancro do ovário que varia entre 0 e 12. Na mulher pós-menopáusica um IM superior a 5 corresponde a um valor preditivo positivo para malignidade ovárica de 0,47. O uso do «Doppler» a cores permite a distinção entre tumor benigno e maligno, através das diferenças de vascularização. Nesta as células produzem um factor angiogénico que estimula o crescimento do endotélio vascular. Os vasos associados à malignidade têm uma localização central, uma diminuição da muscular média e um aumento do fluxo diastólico, quando comparados com vasos de tumorações benignas. São medidos o índice de pulsatilidade (IP) e a impedância do fluxo, cuja sensibilidade e especificidade para o cancro do ovário são de 94% e 97%, respectivamente.
Os ovários com neoplasia maligna são caracterizados por ter vasos de localização central com baixa impedância e valores de IP<1. Estas alterações em estádios precoces não estão bem definidas. Na mulher pré-menopáusica recomenda-se que este exame seja efectuado na primeira fase do ciclo.
Quando um CA 125 positivo é combinado com uma ecografia transvaginal positiva o valor preditivo positivo na mulher pós-menopáusica aproxima-se de 100%.
A Universidade de Kentucky utiliza um protocolo de seguimento específico para rastrear mulheres assintomáticas e pós-menopáusicas (Figura 1).
De Priest e colaboradores aplicaram este protocolo num primeiro estudo em que as mulheres com COv detectado estavam vivas e sem evidência clínica ou imagiológica de doença, 1 a 6 anos a seguir à terapêutica.
No seguimento deste 1º estudo ficaram aproximadamente 20 000 casos em Follow-up e nesta população não houve mortes por cancro primário do ovário.
13
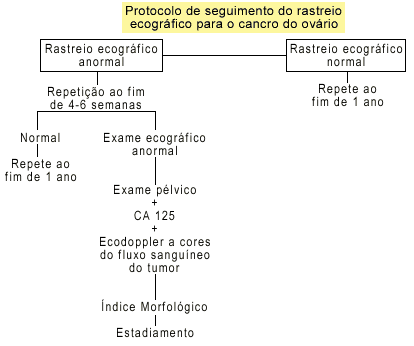
Figura 1
Protocolo de seguimento do rastreio ecográfico para o cancro do ovário
Universidade de Kentucky
Os custos deste tipo de rastreio foram determinados.
Os custos anuais directos são superiores no primeiro ano de rastreio pela aquisição do equipamento e diminuem com o avançar dos anos. O estudo dos custos indirectos determinou que a utilização do rastreio em mulheres assintomáticas pós-menopáusicas é mais vantajoso do que o tratamento de uma doente em estádio III ou IV. Recentemente especial atenção tem sido prestada aos aspectos genéticos do COv particularmente depois da identificação dos genes
BRCA1 e BRCA2.
Na Austrália e Inglaterra as Clínicas de Cancro Familiar abordam multidisciplinarmente os doentes referenciados que têm alto risco de contrair cancro, nomeadamente cancro do ovário.
A prática corrente nestas doentes consiste em:
1º - Excluir malignidade através do exame físico.
- Rever a história familiar para confirmação do diagnóstico.
- Determinar o risco pelo número de familiares atingidos e a sua idade de diagnóstico.
O teste do DNA pode ser feito em famílias suspeitas de ter uma mutação de alto risco num gene relacionado com o cancro.
2º - Seguimento e rastreio somente para portadores reconhecidos de mutações genéticas de alto risco para o cancro do ovário:
- Exame pélvico anual
- Ecografia transvaginal anual
- CA 125 anual
3º - Prevenção:
- Baixa ingestão de álcool
- Dieta seguindo as recomendações da National Heart Foundation.
- Excluir estrogénios exógenos
4º - Cirurgia profilática
- Ooforectomia bilateral.
Não se sabe ainda se o rastreio anual reduzirá significativamente a mortalidade do COv na população rastreada. É prematuro quer condenar o rastreio, quer concluir que ele é eficaz e que deve ser adoptado. Não há estudos multicêntricos para esclarecer o efeito protector do rastreio numa larga população de mulheres pós-menopáusicas e assintomáticas mas dados actuais indicam que o rastreio do COv com ecografia transvaginal, reduz o estádio por altura da detecção. Espera-se que o futuro na área da genética molecular permita seleccionar as mulheres de risco. No entanto é preciso ter presente que tanto o
diagnóstico quanto o estadiamento do cancro do ovário são
cirúrgicos, e não existem exames complementares totalmente fiáveis para a confirmação diagnóstica.
9
Prevenção primaria
Até à data a prevenção do cancro na mulher tem sido orientada para a quimioprevenção.
O uso de contraceptivos orais (CO) combinados tem um efeito protector. Foi encontrado um efeito protector com um risco relativo 0,3 a 0,6 em três estudos populacionais realizados no Reino Unido e um nos Estados Unidos da América.
Uma recente meta-análise demonstrou a consistência dos estudos anteriores com um «Odds Ratio» (OR) de 0,7 para controlos hospitalares e de 0.6 em controlos comunitários. Os estudos «randomizados» tiveram um somatório de risco relativo de 0,4.
Globalmente a mulher que usou CO combinados tem 40% de redução no risco. O efeito protector torna-se evidente após 3 a 6 meses de uso e a protecção aumenta com a duração de utilização. Com mais de 10 anos de CO, o OR desce para 0,2. A protecção persiste, pelo menos por 15 anos após a sua descontinuação.
Desconhece-se actualmente alguma outra droga que tenha mostrado conferir tal protecção. Duas teorias têm sido citadas. Uma pretende que em cada ovulação o epitélio ovárico, no local da rotura folicular, fique exposto a um processo de reepitelização celular ininterrupto, desencadeando o risco de transformação celular atípica; uma ovulação incessante pode levar cumulativamente a um aumento do risco de COv. Qualquer evento que induza anovulação deve baixar o risco. A outra hipótese é de que os CO protegem ao suprimir as gonadotrofinas.
A amamentação aparece como factor de diminuição do risco COv. Numa recente análise de 12 estudos caso-controlo, as mulheres multíparas e que amamentam um filho, têm um risco baixo de COv quando comparadas com as multíparas que não amamentaram. Cada mês de amamentação estava associado a uma redução global do risco de 0,99. A
esterilização tubária também aparece como factor de redução do risco. A protecção atribuída explica-se pelo isolamento ovárico dos agentes carcinogénicos vindos do meio exterior (esperma, partículas inertes de látex colocadas na vagina). Pelo mesmo motivo a
histerectomia protege mas em menor grau.
No Fox Chase Cancer Center em Filadélfia, às mulheres com história familiar de Sindroma de Cancro Hereditário (ovário/mama e Lynch II com 2 ou mais familiares em 1º ou 2º grau) é recomendado, profilaticamente, remover os ovários por via laparoscópica, após planificação familiar completa ou depois dos 35 anos. Esta castração ovárica tem sido seguida por outras equipas de trabalho.
Nenhum governo ou organização não governamental tem promovido a prevenção primária do cancro ginecológico. Como resultado as mulheres continuam a desconhecer que o risco de aparecimento destes cancros pode ser reduzido.
O tratamento do COv é devastador sob o ponto de vista emocional, físico, sexual e financeiro. Há muitas estratégias eficazes e práticas.
Estas atitudes inserem-se num política global de Educação para a Saúde, cuja aplicação depende não só do empenho e actuação determinada dos profissionais de saúde mas também do compromisso governamental.
14
Bibliografia
Adams M, Evans AS, Peet E. Cancros do foro Ginecológico. Update 1999
Jun; 122: 34-45.
Benson M D.
Gynecologic Pearls. A Practical Guide for the Efficient Resident.
Philadelphia: Davis, 1995; cap 15: 205-215.
Beral V,
Hannaford P, Kay C. Oral contraceptive use and malignancies of the genital
tract. Results from de Royal College of General Practitioner's oral
contraception study. Lancet 1988; 2: 1331-5.
Brinton LA,
Hoover RN. The Endometrial Cancer Colaborative Group. Estrogen replacement
therapy and endometrial cancer risk - unresolved issues. Obstet. Gynecol.
1993; 81: 265-71.
Broderick
K, Feldstein VA. Ultrasound evaluation of the Uterus and Endometrium. Curr
Probl Obstet Gynecol Fertil 1997 Sept/Oct; 20(5): 155-64.
Di Saia PI.
Danforth's Obstetrics and Gynecologic. 7th ed. Philadelphia: Lippincott,
1994; cap.51: 007-8.
Folsom AR,
Kaye AS, Potter JD, Prineas RJ. Association of incident carcinoma of the
endometrium with body weight and fat distribution in older women: early
findings of the Iowa Women's Health Study. Cancer Res 1989; 49: 6823-31.
Fontaine P.
Endometrial Cancer, Cervical Cancer and the Anexal Mass. Primary Care.
1998 Jun; 25 (2): 433-455.
Grimes DA,
Economy KE. Primary prevention of gynecologic cancers - current
development. Am J Obstet Gynecol 1995 Jan; 172 (1 Pt 1): 227-34.
Lopes TM,
Arraiano MB. Endometrial Cancer Prevalance in Postmenopausal Women from
Gynecology Consultation between 1991-1996. XV Figo World Congress of
Gynecology and Obstetrics; Copenhagen 3-8 Aug 1997.
Pipa A,
Nogueira Martins F, Oliveira E. Carcinoma do endométrio - estadiamento
cirúrgico - breve revisão teórica. Revista de Ginecologia e Medicina da
Reprodução 1996 Junho; 21 (2): 47-54.
Pipa A,
Santo SE, Oliveira E, Santos I, Pereira da Silva D. Carcinoma do endométrio
- estadiamento cirúrgico. Revista de Ginecologia e Medicina da Reprodução,
1996 Dez; 21 (3): 65-73.
Ramcharan
S, Pellegrin FA, Ray R, Hsu JP. The Walnut Creek contraceptive drug study
- a prospective study of the side effects of oral contraceptives. National
Institute of Child Health and Human Development; Bethesda 1981.
Rivoire WA,
Monego HI, Binda AM. Neoplasias do corpo uterino. In: Freitas F, Menke C
H, Rivoire W, Passos E P. Rotinas em Ginecologia, 3 ed. Porto Alegre:
Artes Médicas, 1997: 171-185.
Rosenblatt
KA, Thomas DB. The Who Collaborative Study of Neoplasia and Steroid
Contraceptives. Hormonal content of combined oral contraceptives in
relation to the reduced risk of endometrial carcinoma. Int. J. Cancer
1991; 49: 870-4.
Santo SE,
Cardoso EO, Pipa A, Torres J, Colaço MAS, Pereira da Silva D. Carcinoma
do endométrio - epidemiologia, factores de risco. Revista de Ginecologia
e Medicina da Reprodução, 1996 Dez; 21 (3): 61-4.
Serra A,
Hricak H. Gynecologic Imaging: practical applications for Magnetic
Resonance Imaging. Curr Probl Obstet Gynecol Fertil 1997 Sept/Oct; 20(5):
165-81.
Shapley M,
Redman C W E. Endometrial sampling and general practice. British Journal
of General Practice 1997 Jun; 47:387-392.
Shelly M S.
Endometrial Biopsy. American Family Physician 1997, April; 55 (5):
1731-1736
Smith CB. Transvaginal Ultrasonography and Endometrial Thickness (carta).
American Family Physician 1996 May; 57 (7): 2282-3.
Stevens A.;
Lowe J. Pathology. London: 1995; cap 17: 361-386.
The Cancer
and Steroid Hormone Study of the Centers for Disease Control and The
National Institute of Child Health and Human Development. Combination oral
contraceptive use and the risk of endometrial cancer. JAMA 1987; 257:
796-800.
Trias de
Bes SD, Galofré PJ G, Xauradó RF, Mayol XF, Melcior BG, Nicolau RL, et
al. Cancer de endometrio. In: Mason A S, editores. Sinopsis de Oncología
Genecológica 1996: 130-44.
Vessey MP.
An overview of the benefits and risks of combined oral contraceptives. In:
Mann R D, editor. Oral contraceptives and breast cancer. Carnforth:
Parthenon, 1990: 121-35.
Voigt LF,
Weiss NS, Chy J, Daling Jr., Mckinght B, van Belle G. Progestogen
supplementation of exogenous and risk of endometrial cancer. Lancet 1991;
338:274-7.
World
Health Organization. Depo-medroxyprogesterone acetate (DPMA) and cancer:
memorandum from a WHO meeting. Bull 1993; 71: 669-76.
|

